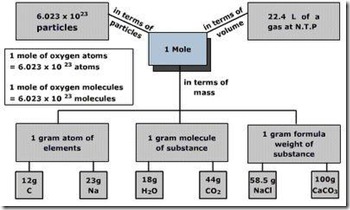
Konsep Mol - Perhitungan Kimia | Sekedar mengingatkan anda lagi, di kelas sepuluh, Andi Goda dan kita telah mempelajari hubungan antara Mol, Jumlah partikel, dan massa dalam gram sebagai berikut ini
Hukum Perbandingan Tetap ( hukum proust) dalam senyawa AxBy adalah :
itulah sedikit materi pelajaran dan pendidikan kimia saat ini setelah kemarin saya juga membuat sebuah PROPOSAL SOCCER COMMUNITY untuk perusahaan saya. silakan dibaca juga ya.
Sekian pelajaran kita mengenai Konsep Mol - Perhitungan Kimia pada kesempatan ini. semoga bermanfaat. Terima kasih dan salam berbagi.

Jumlah Partikel = mol x L
mol = jumlah partikel / L
L = Bilangan Avogrado = 6 x 10pangkat23
Gram = mol X Ar atau Mr
Ar atau Mr = gram / mol
mol = gram / Ar atau Mr
jumlah partikel / L = gram / Ar atau Mr
Rumus Empiris
Rumus Empiris adalah rumus yang menyatakan perbandingan terkecil atom – atom unsur yang menyusun suatu senyawa. Cara menentukan rumus empiris adalah sebagai berikut- Hitungan gram atau persen masing – masing unsur penyususn senyawa
- Bagi dengan Ar yang bersangkutan, sehingga akan diperoleh perbandingan mol terkecil.
Rumus Molekul
Rumus Molekul adalah rumus yang menyatakan jumlah atom – atom unsur yang menyusun satu molekul senyawa. Untuk menentukan rumus molekul senyawa, kita harus mengetahui atau menghitung lebih dahulu- rumus empiris senyawa
- Mr senyawa
Hukum Perbandingan Tetap ( hukum proust) dalam senyawa AxBy adalah :
Berat A = x X Ar.A / Mr senyawa X berat senyawa
Berat B = y X Ar.B / Mr senyawa X berat senyawa
itulah sedikit materi pelajaran dan pendidikan kimia saat ini setelah kemarin saya juga membuat sebuah PROPOSAL SOCCER COMMUNITY untuk perusahaan saya. silakan dibaca juga ya.
Sekian pelajaran kita mengenai Konsep Mol - Perhitungan Kimia pada kesempatan ini. semoga bermanfaat. Terima kasih dan salam berbagi.
Anda baru saja membaca artikel yang berkategori Kimia
dengan judul Konsep Mol - Perhitungan Kimia. Anda bisa bookmark halaman ini dengan URL http://andigoda.blogspot.com/2013/07/konsep-mol-perhitungan-kimia.html. Terima kasih!
Ditulis oleh:
Andi godaa -
Rating: 4.5 oleh 245 Orang











Belum ada komentar untuk "Konsep Mol - Perhitungan Kimia"
Post a Comment