Artikel hari ini mengenai Pengertian dan Rumus Perubahan Entalpi yang sengaja Andi Goda terbitkan agar anda semua mengingat masa sekolah dahulu ketika sedang mengikuti pelajaran Kimia, Ilmu pengetahuan Alam ( IPA ). kemarin saya juga membahas Perkembangan Termokimia dan Ilmuannya yang juga merupakan Ilmu Kimia
Kita tahu Alam semesta yang merupakan ciptaan Tuhan ini mempunyai energi yang konstan. Berdasarkan asas kekekalan energi, kita tidak mungkin bisa menciptakan / membuat dan memusnahkan suatu energi. yang dapat kita lakukan hanyalah mengubah suatu bentuk energi tersebut menjadi sebuah bentuk energi yang lainnya
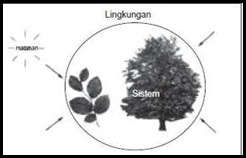
Sistem merupakan suatu yang sedang kita pelajari suatu perubahan energinya, dan apa saja yang berada diluar sistem disebut sebagai Lingkungan. Suatu sistem mampu menyerap energi dari lingkungan ataupun melepaskan energi menuju lingkungan. dalam Ilmu kimia, Yang dimaksudkan dengan sistem adalah suatu reaksi kimia atau zat-zat yang kita reaksikan. Sedangkan tabung reaksi atau gelas kimia beserta segala sesuatu di sekelilingnya merupakan lingkungan.
Entalpi atau dalam kimia lambangnya H adalah jumlah energi yang terkandung atau tersimpan dalam suatu zat pada suhu 298 K (25 derajat C) dan tekanannya 1 atm. istilah entalpi diambil dari bahasa jerman, Entalpien yang berarti kandungan dan juga diusulkan pada tahun 1847 oleh hermann helmholtz.
sebagaimana kita maklumi, pada setiap reaksi kimia selalu berbentuk zat yang baru. oleh karena masing-masing zat mengandung jumlah energi yang berbeda-beda ( memiliki entalpi yang tidak sama), maka setiap reaksi kimia selalu disertai oleh Perubahan Entalpi (ΔH)
ΔH = entalpi hasil reaksi – entalpi pereaksi
ΔH = H ruaskanan – H ruaskiri
contoh reaksi sederhana ( A -------> B )
ΔH = HB - HA
dengan :HA = entalpi pereaksiHB = entalpi hasil reaksiΔH = Perubahan Entalpi
Dari perubahan entalpi ini, kita akan menemukan 2 jenis reaksi kimia. yang selanjutnya akan saya bahas di 2 jenis reaksi kimia dari perubahan entalpi.
Demikian pembahasan saya tentang Pengertian dan Rumus Perubahan Entalpi pada kesempatan kali ini. Semoga anda ingat lagi serta bertambah pintar kembali. Selamat belajar.